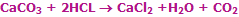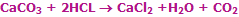قانون بقای جرم (2)
در گذشته خواندید که آزمایش لاووازیه کمی بود در حالی که پریستلی این آزمایش را کیفی نتیجه گیری کرده بود. در ادامه این بحث به دیگر کارهای لاووازیه و کشف گازهایی که در تکمیل نظریه های قدیمی مانند فلوژیستون مطرح شدند، اشاره خواهیم کرد.
لاووازیه را اکنون به عنوان پدر شیمی مدرن می شناسیم. با این وجود ، زمانی که لاووازیه آزمایش های خود را بر روی احتراق و تنفس شروع کرد، علم شیمی هنوز در مراحل اولیه ی پیشرفت به سر می برد؛ اطلاعات تجربی زیادی وجود داشت اما زمینه های نظری بسیار کمی در دسترس بود و هیچ زبان قراردادی برای این اطلاعات وجود نداشت.
مشخصات کافی از اسیدها ، بازها ، نمک ها و فلزات شناسایی شده بود تا جایی که می توانستند معمولاً تشخیص داده شوند ، اما گازها آن چنان شناخته شده نبودند. در انتهای این مطلب، تاریخچه ای مختصر راجع به برخی گازهای معروف و کشف آن ها خواهیم خواند
لاووازیه به راحتی اکتشافات تجربی دیگر دانشمندان را تثبیت کرده و گسترش داد و مدل های ذهنی را برای نظم دادن به تمام این ایده ها شکل داد. او از معدود دانشمندانی بود که اهمیت اندازه گیری دقیق واکنش دهنده ها و محصولات را کاملاً درک کرد. به منظور چنین اندازه گیری های دقیقی، او ترازویی اختراع کرد که حدود 0/0005 گرم دقت داشت. او قانون بقای جرم را ثابت کرد و نشان داد که جرم واکنش دهنده ها باید با جرم محصولات برابر باشد؛ به بیان دیگر:
در یک واکنش شیمیایی، ماده نه به وجود می آید نه از بین می رود.
تنفس:
لاووازیه نشان داد که در فرایند تنفس، اکسیژن مصرف می شود و دی اکسید کربن بیرون داده می شود. وی در سال 1783 شروع به آزمایش های اندازه گیری گرما با استفاده از یک کالری متر کرد و نشان داد که گرمای تولید شده در فرایند تنفس، مساوی با گرمای تولید شده در هنگامی است که همان مقدار اکسیژن برای سوزاندن زغال چوب مصرف می شود.
وی همچنین از یک کالری متر برای یافتن گرمای ویژه ی مواد مختلف و اندازه گیری گرمای تولید شده در واکنش های شیمیایی استفاده کرد.
حالت های ماده:
لاووازیه در دوران تحصیل خود آموخت که مواد مایع، هم توسط تغییر فاز دادن به هوا و هم حل شدن در هوا تبخیر می شوند (مانند حل شدن نمک در آب).
لاووازیه نشان داد که تمام مواد می توانند در سه طبقه جای گیرند. با این وجود، او عقیده داشت که این تغییرات در حالت، نتیجه ی ترکیب آتش با ماده است. این "ماده ی آتش" یا "کالریک"، بی وزن است و با جامد ترکیب می شود تا مایع تشکیل دهد و با مایع تشکیل می شود تا گاز تشکیل دهد.
نام گذاری:
لاووازیه و گروه کوچکی از دیگر دانشمندان، روش نام گذاری شیمیایی را ایجاد کردند که تفاوت های بین عناصر را طبقه بندی کنند. لاووازیه همچنین تفاوت های بین عناصر و ترکیبات را واضح تر توصیف کرد.


.
کوره آفتابی که برای جمع کردن نور خورشید توسط لاووازیه اختراع شد

تاریخچه ی کشف گازهای معروف(اطلاعات کلی):
دی اکسید کربن ((CO2: هوای ماندگار
دی اکسید کربن اولین گازی بود که به عنوان یک ماده ی خالص مشخص و تهیه شد. حدود سال 1750 این گاز توسط جوزف بلک مورد مطالعه قرار گرفت؛ وی این گاز را "هوای ماندگار" یا "هوای ثابت" نامید. اطلاعات راجع به هوای ماندگار از طریق معادله ی زیر به دست می آید:
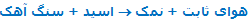
معادله ی جدید:
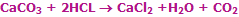
در حالی که جوزف بلک نتوانست هیچ مصرف تجاری برای این گاز پیدا کند، جوزف پریستلی در سال 1772 در لندن، نوشیدنی های گازدار کربنات دار را به دست آورد.
نیتروژن (N2): هوای مرده
کشف نیتروژن حدود سال 1772 مشخص شد اما کاشف واقعی آن معلوم نیست. فردی به نام "شیلی" بیان کرد زمانی که هوا در جایی محبوس شود، قسمتی از هوا می تواند با واکنش با پوشش آهنی نم دار بیرون بیاید و هوای باقیمانده، نظریه ی احتراق را تأیید نخواهد کرد. این هوای باقیمانده، "گاز ماندگار" نبود زیرا با آب آهکی که در بالا ذکر شد، رسوب نداد. از آن جایی که این گاز، شامل نظریه ی احتراق یا دلیل حیات نبود، "هوای مرده" نام گرفت.
هیدروژن (H2): هوای اشتعال پذیر
هیدروژن توسط هنری کاوندیش کشف شد؛ وی در تحقیق علمی اش راجع به "هواهای مصنوعی" این گاز را توصیف کرده و در سال 1766 آن را منتشر کرد. این گاز که او آن را با ترکیب یک فلز با اسید (معادله ی زیر) تولید کرد، چگالی بسیار کمی نیز داشت و در ابتدا "گاز اشتعال پذیر" نامیده شد.
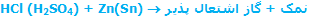
اکسیژن (O2): گاز آتش
اکسیژن که حدود یک پنجم اتمسفر را تشکیل می دهد، در اصل به نام های "گاز آتش" و "گاز ضدآتش" بود. این گاز توسط جوزف پریستلی در سال 1774 که با گرم کردن اکسید قرمز جیوه آن را به دست آورد، کشف شد.با این وجود، به بیان امروزی، واکنش اصلی به این صورت بود:
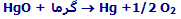
پریستلی فهمید که هوا ماهیت آتشی خود را از دست می دهد؛ به صورت زیر:
هوا + X = هوای آتش گیر (نیتروژن)
هوا - X = هوای ضد آتش (اکسیژن)
جمع بندی :
1) لاووازیه حدس زد فرایند سوختن در واقع یک ترکیب شیمیایی با اکسیژن است.
2) او فهمید به مفهوم تازه ای از عناصر، مواد مرکب و تغییر شیمیایی نیاز است.
3) اکنون ما می دانیم که 89 عنصر به طور طبیعی در پیرامون ما یافت می شود و در نهایت، 23 عنصر با عمر کوتاه که به طور مصنوعی ساخته می شوند، وجود دارند.